质谱3Q验证全流程深度解析:从GMP合规到数据可靠性的系统化实践
发布时间:2025/05/16
点击次数:374
一、3Q验证的法规基础与核心框架
质谱3Q验证体系源于USP <1058>和GMP附录2的强制性要求,其核心是通过IQ(安装确认)、OQ(运行确认)、PQ(性能确认)三阶段验证,确保质谱数据的可靠性。根据2021版USP <1058>标准,分析仪器被划分为三类:
- A类:无需验证(如磁力搅拌器)
- B类:简化验证(如pH计)
- C类:完整3Q验证(质谱仪属于此类)
验证过程需遵循生命周期管理模型,从用户需求规范(URS)开始,贯穿仪器整个使用周期,直至报废。
二、分阶段验证技术要点解析
1. 安装确认(IQ)关键控制点
| 项目 | 技术要求 | 合规依据 |
|---|---|---|
| 环境条件 | 温度20±2℃,湿度45-65%RH | GMP附录2 |
| 气源系统 | 氦气纯度≥99.999%,压力波动<0.5psi | ISO 8573-1:2025 |
| 文件完整性 | 含厂商资质、校准证书等12类文件 | USP <1058> 4.2条款 |
需特别检查涡轮泵真空度(应<5×10⁻⁵Torr)和离子源安装精度(偏差≤0.1mm)。
2. 运行确认(OQ)性能测试
- 质量准确性:采用PFTBA标准品,m/z 502分辨率需>2000
- 灵敏度验证:1pg八氟萘信噪比(S/N)≥100:1
- 线性动态范围:5-6个数量级(R²≥0.995)
- 碰撞能量稳定性:CE值波动<±5%(三重四极杆)
测试公式:
R=mΔmR=\frac{m}{Δm}
其中R为分辨率,m为质量数,Δm为半峰宽。
3. 性能确认(PQ)实施策略
- 已知浓度样品:回收率85-115%
- 未知样品检测:与参考方法偏差<15%
- 长期稳定性:连续5天测试RSD<10%
- 系统适用性测试:保留时间偏差≤±0.5%
三、特殊场景下的验证挑战
-
二手仪器验证
需增加历史使用评估:- 电子倍增器计数检查(<10⁷ counts)
- 四极杆射频电压漂移测试(<5%)
- 离子源透镜污染度评估
-
计算机化系统验证
根据GAMP5要求,需同步执行:- 软件功能测试(如Analyst软件)
- 审计追踪验证
- 数据完整性检查(符合ALCOA+原则)
-
再验证触发条件
- 仪器维修后(涉及真空系统需全验证)
- 方法变更时(如LC条件改变)
- 年度定期验证
四、常见失效模式与解决方案
-
质量轴漂移
根本原因:四极杆温度波动
解决方案:预热24小时+环境温度控制 -
灵敏度下降
诊断流程: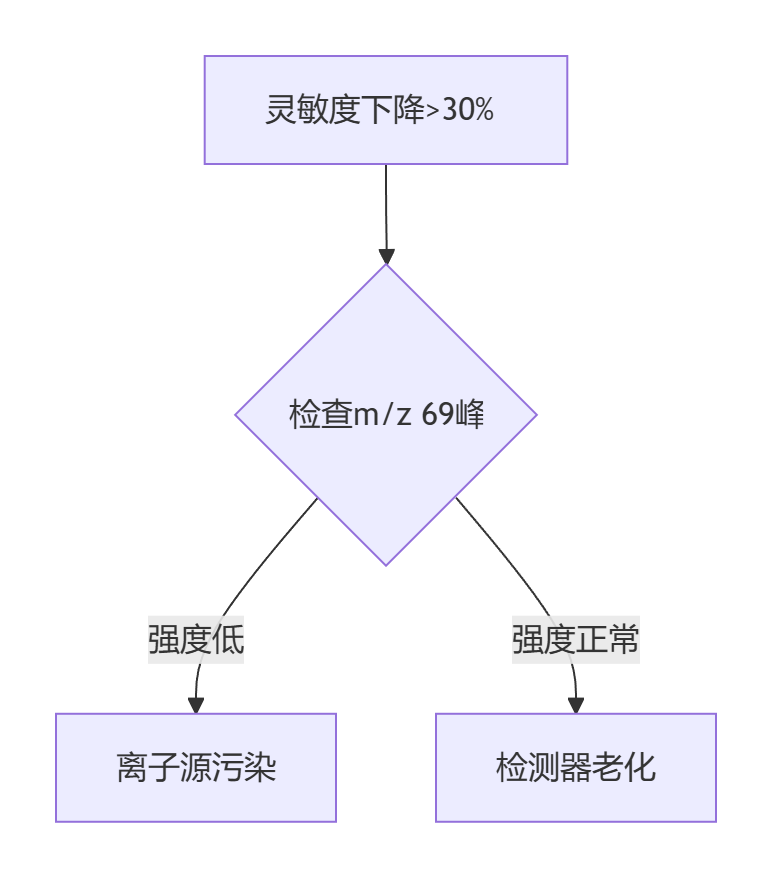
-
数据合规风险
通过电子签名+时间戳确保符合21 CFR Part11,原始数据需保留至产品有效期后1年。
质谱3Q验证是确保数据可靠性的系统工程,需结合风险评估(FMEA方法)和生命周期管理,在2025版GMP要求下,建议采用模块化验证策略,将传统6个月验证周期缩短至4周,同时降低30%验证成本。对于关键制药应用,必须执行完整验证流程,并保留所有原始记录备查。

